L929がTNFαによって障害を受ける性質を利用して、TNFα感受性試験を行う方法です。保有している3株のL929細胞(RCB1422、RCB1451、RCB2619)を使用し、クリスタルバイオレットを用いて感受性の違いを比較する方法をご紹介します。
*バイオアッセイについて
この方法で既知のTNFαを用いて検量線(クリスタルバイオレットで染色された割合)を作成した後、検体の値と検量線を比べることにより、検体のTNFα濃度を測定することができます。
<参考文献>
Current Protocols in Immunology. 2001 Chapter 6 : Unit 6.10 「Measurement of TNFα and TNFβ」
1. 準備するもの
(1)細胞と培地
- L929細胞(RCB1422, RCB1451, RCB2619)
- 培養培地
RCB1422 : MEM+10%HS+0.1mM NEAA
RCB1451 : MEM+5%CS
RCB2619 : RPMI1640+10%FBS
※今回は3細胞の比較を行うため、アッセイの時のみ「MEM+10%HS+0.1mM NEAA」を使用。
(2)試薬
- BSA(岩井化学薬品社, #0125R)
0.1% BSA溶液を0.22μmフィルターで濾過滅菌する。 - TNFα(SIGMA社, #T7539)
濾過滅菌後の0.1% BSA溶液1mlに10μgのTNFαを溶解する。(10μg/ml sol.) - Actinomycin D(SIGMA社, #A9415)
ストック溶液は、500μg/mlとなるようにメタノールに溶解し、0.22μmフィルターで濾過滅菌する。
使用時に4μg/mlとなるように培地で希釈する。
(注:Actinomycin D は、用時解凍で使用する。凍結融解は繰り返さず、使いきりが望ましい。) - 10% 中性緩衝ホルマリン溶液(和光純薬社, #062-01661)
- 0.4% クリスタルバイオレット溶液(東京化成工業社, #C0428)
- PBS(+)
- メタノール(SIGMA社, #19-2410)
測定当日に70%溶液となるように希釈する。発熱するので室温まで冷ましてから使用する。
(3)容器
- 96ウェル マイクロプレート(平底)(BD Falcon社, #353072)
2.方法
(1)細胞の播種
- 96ウェル マイクロプレートにL929細胞を2×104 cells/100μl/wellで播種する。
- 37℃, CO2 5%のインキュベーターで一晩培養する。
(2)TNFαの添加
- 別容器でTNFαを希釈する。(実験では段階希釈により0.01~10ng/mlに調製したものと、100ng/mlに調製したものを使用)
- 播種翌日に細胞がコンフルエントになっていることを確認し、培地を除く。(注:L929は必ずコンフルエントの状態で用いること。コンフルエントにならない場合は、播種細胞数を増やすか、培養時間を長くする。)
- 新たに培地を100μl/wellで添加する。
- 1)で作成したTNFα溶液を、3)のwellに50μl/wellで添加する。
- 4μg/mlに希釈したActinomycin D溶液を50μl/wellで4)のwellに添加する。
- 37℃, CO2 5%のインキュベーターで18時間培養する。
(3)クリスタルバイオレット染色 (毒性試験(MTT法等)でも測定可能)
- 培養液を除く。
- PBS(+)を200μl/well加える。
- 2~10分放置する。
- PBS(+)を捨てる。
- 10% 中性緩衝ホルマリン溶液を100μl/well加え、室温で30分以上置く。(ホルマリン溶液は乾きやすいので、乾かないように注意する。)
- ホルマリン溶液を除き、PBS(+)を100μl/well加える。
- PBS(+)を捨てる。
- 0.4% クリスタルバイオレット溶液を80μl/well加え、室温で15~30分置く。
- クリスタルバイオレット溶液を取り除き、良く水洗する。
- 伏せて乾かす。
(4) 測定
- 70%メタノール溶液を200μl/well加え、室温で5分置く。
- 抽出されたクリスタルバイオレットが均一になるように軽く揺する。
- 595nm(Single)の吸光度を測定。
3.判定
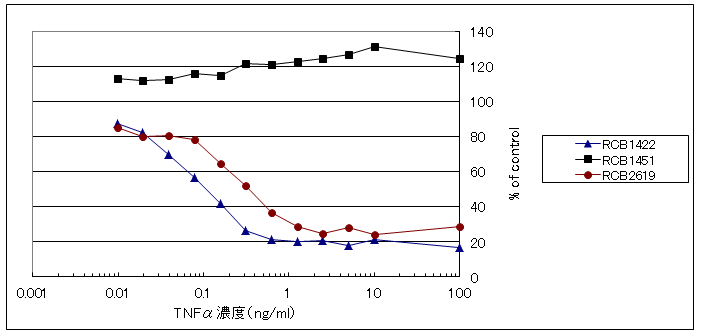
TNFαを添加していないウェルを、コントロールとした。コントロールを100%としたときの、TNFα(または検体)を添加したウェルの生細胞数(クリスタルバイオレットで染色された細胞)の割合(%)を下記グラフに示した。
RCB1422とRCB2619は、TNFα添加することにより、濃度依存的に細胞が死滅した。
RCB1451は、100ng/mlのTNFαを添加しても、細胞は死滅しなかった。