ヒト細胞材料の由来個体の識別同定、起源の確認、クロスコンタミネーションなどを確認するために、Short Tandem Repeat (STR) 多型解析を行っています。この検査方法はPCRを利用した簡便で信頼性の高い遺伝子多型解析方法の一種です。
当室が保有している全ヒト由来細胞株(当室で培養を行わないものを除く)に関してSTR検査を実施して提供しています。
1. 準備するもの
(1) 検体
- 検査細胞株から抽出したゲノムDNA
(2) 機器・PCRチューブ
- PCRチューブ( 0.2ml PCRチューブ、PCR用96ウェルプレート等)
- トレー/リテーナー(PCR容器に適合するもの)
- サーマルサイクラー(Gold 96-well GeneAmp PCR system 9700、Applied Biosystems)
- 96well泳動プレートMicroAmp Optical 96-well Reaction Plate (Applied Biosystems Cat#N8010560 10枚)
- Applied Biosystems 3130 Genetic Analyzer(Applied Biosystems)
- 3100/3130/3730 96-wellプレートセプタ(Applied Biosystems Cat#4315933 20枚)
- 3130 36-cm Capillary Array 47cm×50μm 4本/アレイ(Applied Biosystems Cat#4333464)
- 3100/3130 96-well プレートリテーナー(Applied Biosystems Cat#4317241 4枚)
(3) PCR Primer
- PowerPlex 16 HS System (Promega Cat#DC2101)
Krenke, Benjamin E., et al. “Validation of a 16-locus fluorescent multiplex system.” Journal of forensic sciences 47.4 (2002): 773-785.
(4) 試薬
- PowerPlex 16 HS System (Promega Cat#DC2101)
キット内容(使用する試薬のみ抜粋)
PowerPlex HS 5×Master Mix
PowerPlex 16 HS 10×Primer Pair Mix
PowerPlex 16 HS Allelic Ladder Mix
Internal Lane Standard(ILS)600 - Hi-Di formamide(Applied Biosystems Cat#4311320 25ml)
- POP-4 ポリマー(Applied Biosystems Cat#4352755 7.0ml)
- Genetic Analyzer Buffer with EDTA(Applied Biosystems Cat#402824 25ml)
- DDW
2. 方法
(1) 1st-step PCR
1)PCRマスターミックスを調製する。
| 1サンプルあたりの液量 | |
| DDW | 17.0μl |
| PowerPlex HS 5×Master Mix | 5.0μl |
| PowerPlex 16 HS 10×Primer Pair Mix | 2.5μl |
|
|
|
| マスターミックスの液量 | 24.5μl |
2)PCRチューブにマスターミックスを24.5μlずつ分注する。
3)約1ng/μlに希釈したテンプレートDNAを0.5μlずつ加える。
4)PCRチューブをトレー/リテーナーと共にサーマルサイクラーにセットし、下記のサイクルで反応させる。
| Ramp Speed : 9600 | ||||
| 95℃ | 11min | |||
| 96℃ | 1min | |||
| ramp | 100% | 94℃ | 30sec | for 10 cycle |
| ramp | 29% | 60℃ | 30sec | |
| ramp | 23% | 70℃ | 45sec | |
| ramp | 100% | 90℃ | 30sec | for 20 cycle |
| ramp | 29% | 60℃ | 30sec | |
| ramp | 23% | 70℃ | 45sec | |
| 60℃ | 30min | |||
| 4℃ | store | |||
(2) 増幅断片のキャピラリー電気泳動
1)泳動カクテルを調製する。
泳動サンプル数は、検体数+ネガティブコントロール2サンプル+Ladderサンプル数である。
| 1サンプルあたりの液量 | |
| 脱イオン化ホルムアミド | 9.75μl |
| Internal Lane Standard(ILS)600 | 0.25μl |
|
|
|
| カクテルの液量 | 10.00μl |
2)泳動カクテルを10~15秒間ミキサーで攪拌し、泳動用プレートに10μlずつ分注する。
3)増幅サンプル又はPowerPlex 16 HS Allelic Ladder Mixを1μlずつ加える。
4)セプタストリップで蓋をし、95℃、3分間加熱後、直ちに氷上に移し3分間冷却する。
5)サンプルプレートの上にプレートリテーナーをはめる。
6)装置(3130 Genetic Analyzer)にかけ泳動を行う。
(3) データ及び解析
GeneMapper IDソフトウェア(Applied Biosystems)にて解析を行なう。
a) PowerPlex® 16 HS Allelic Ladder:PowerPlex 16 HS System付属のアレリックラダーマーカー
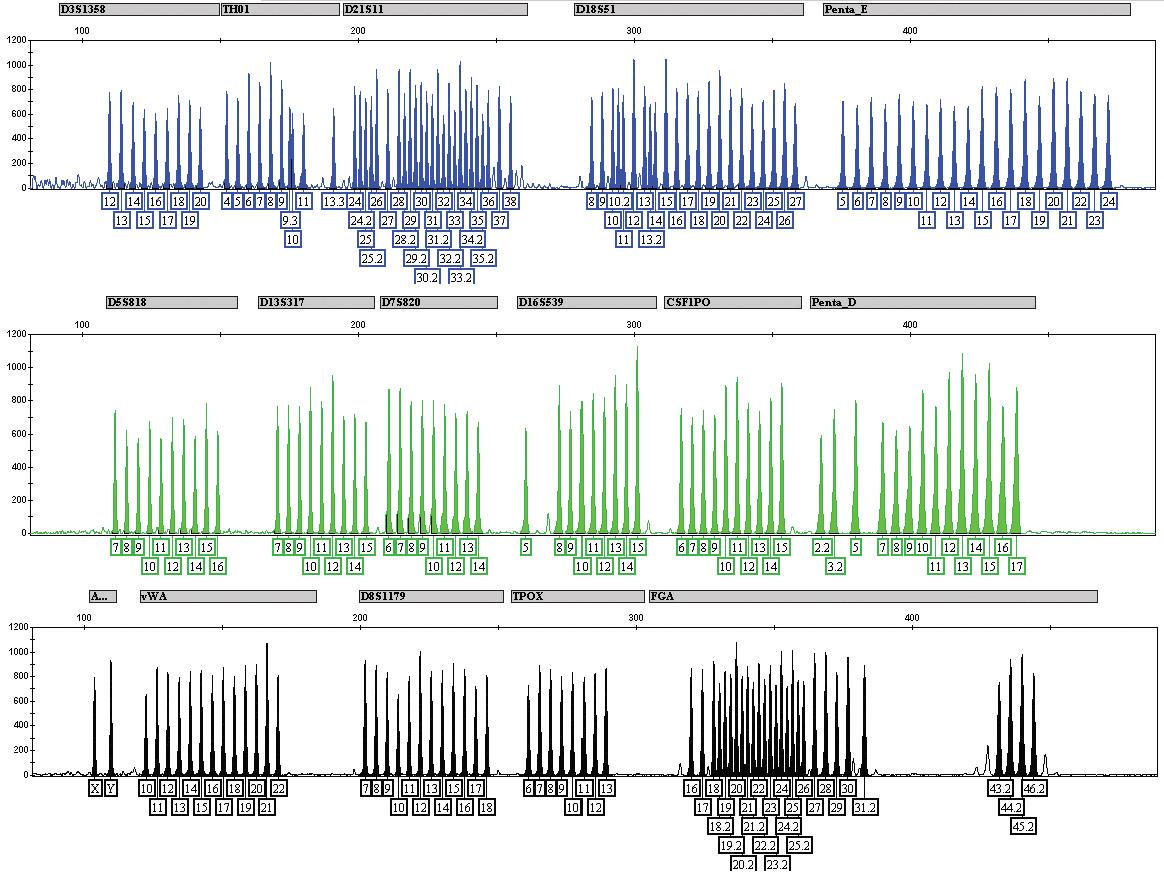
b) RCB0007 HeLa Lot 46の結果
同じローカスのアレリックラダーと機器により比較することで、アレルの割り当てが行なわれる。
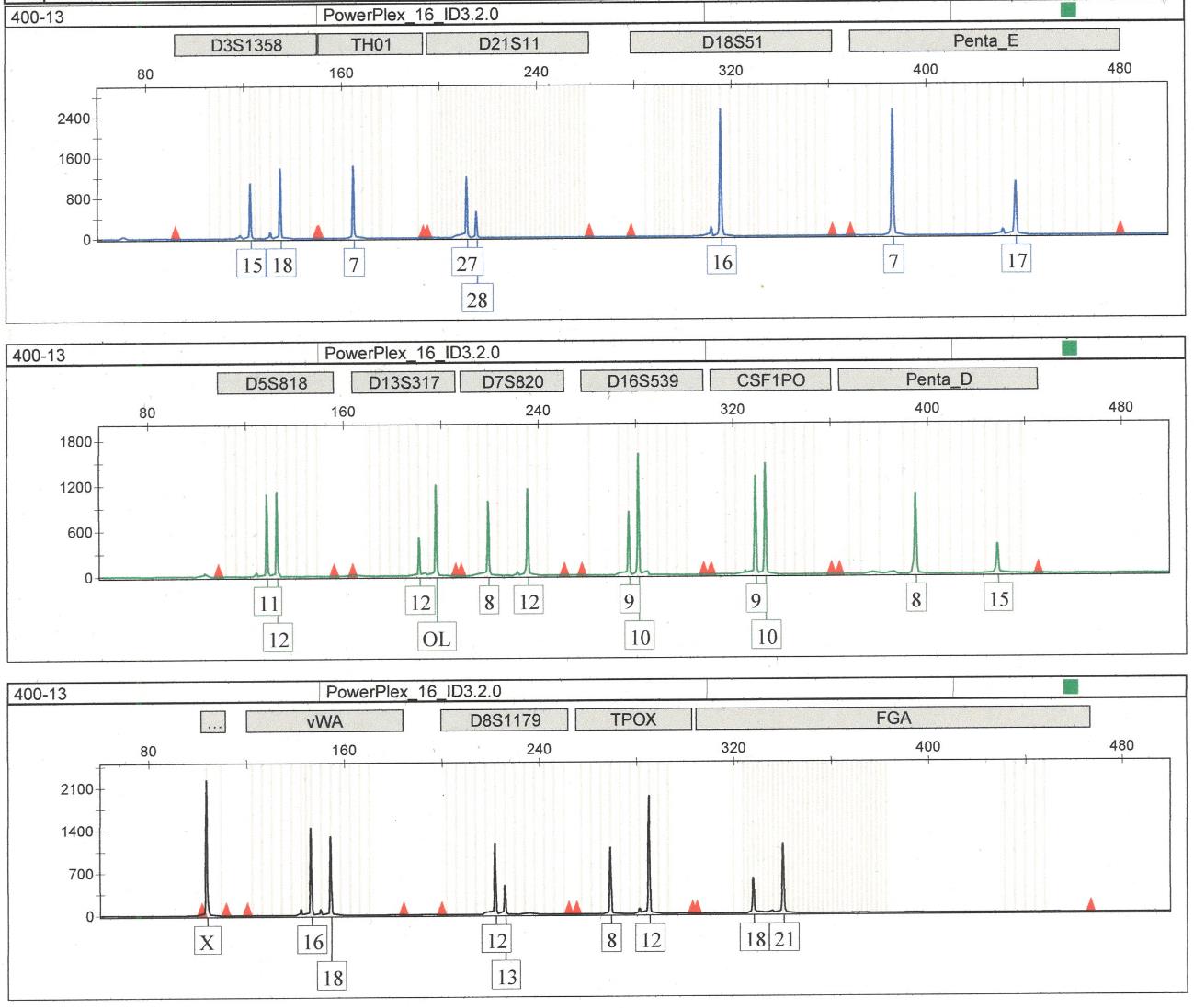
(4) 判定
データベースのデータと照合、確認をする。
細胞認証データベースhttp://jcrbcelldata.nibiohn.go.jp/str/
1)細胞株の判定
識別同定により合格
- 登録済みの他の細胞株の中に一致するものがない→固有の細胞
- 登録済みの他の細胞株の中に一致するものがあっても、文献上別名で認知されている細胞の場合
→OKとなる場合もある
識別同定により不合格
- 登録済みの他の細胞株の中に一致するものがある→取り違い
- プロットデータ中に登録済みの他の細胞株のデータと一致するものがある→他の細胞混入の疑い
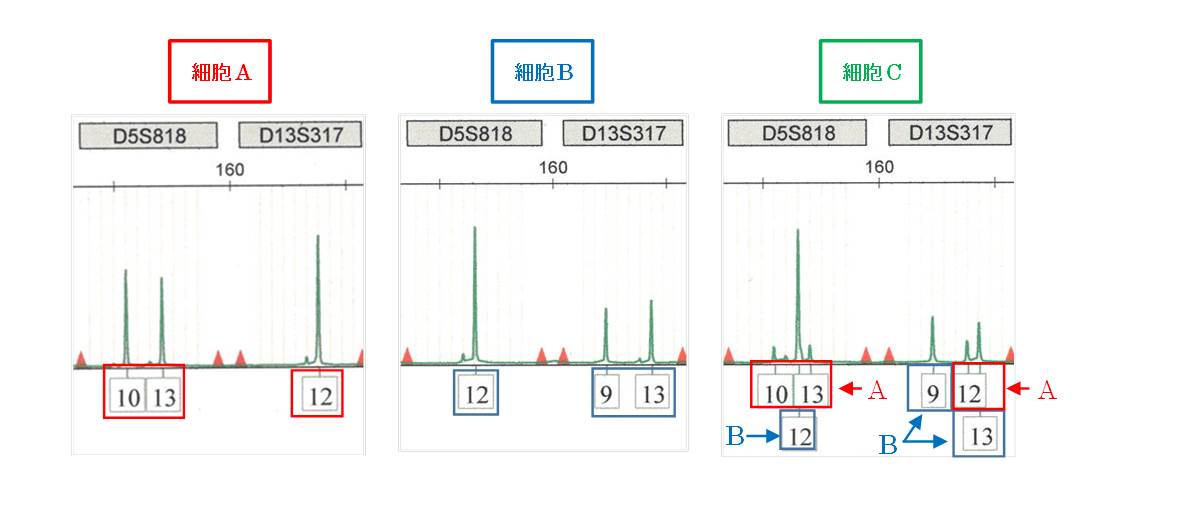
2)≪ 他の細胞の混入例≫ サンプル細胞Cは、細胞Aと細胞Bが混ざっている。