※日本組織培養学会の標準プロトコ-ルに準じて一部改変
1. 準備するもの
・検体
| 調整法 : | 抗生物質を含まない培地で3週間以上培養した細胞を準備し、継代後または培地交換後3日以上経過した培養上清を採取する ※毎日培地交換を必要とする細胞の場合は細胞が十分に増殖したタイミングで培地交換直前の培養上清を用いる |
・Vero細胞 (マイコプラズマに感染していないことを確認済のもの)
細胞濃度 : 1-2 x 104cells / 35dish (0.5mL)
必要なdish数 : 検体の数 + Negative control用 2枚
・Vero細胞用培地
組成 :MEM+10%FBS (用時調製)
・染色原液 (-20℃以下で保存)
室温で30-40分間、スターラーを使ってよく攪拌し、1回に使う必要量を分注し、アルミホイルで完全に包み遮光する
組成 :5.0mg Hoechst 33258 (American Hoechst, Co., 33217)
100mL PBS(-)
100mL PBS(-)
・Mounting solution(PH 5.5に調整、4℃ 保存)
組成 :22.2mL 0.1M クエン酸 (MW 210.14, 2.101g/100mL)
27.8mL 0.2M Na2HPO4・12H2O (MW 358.14, 7.162g/100mL)
50mL グリセロール
27.8mL 0.2M Na2HPO4・12H2O (MW 358.14, 7.162g/100mL)
50mL グリセロール
・固定液
組成 :99% エタノール : 酢酸 = 3 : 1 (用時調製、氷冷)
・ PBS(-)希釈固定液
組成 :PBS(-) : 固定液 = 3 : 1 (用時調製)
・蒸留水
・35mm dish
・カバーガラス 22 x 22 (mm) (乾燥滅菌済み)
・ピンセット
・スライドガラス
・蛍光顕微鏡
2. 方法
| 注意 | (1) – (6) の操作は無菌操作を行う。 (7) – (17) の操作は無菌操作不要。 (8) – (14) の操作間はカバーガラスを乾燥させない。 特に(10) (11)の後で急激な乾燥が起こると細胞の形態が崩れやすくなるので注意。 |
3. 判定
培養細胞に対して、維持培養中に2回以上の検査を行う。
| ・陰性(-): | Vero細胞の核以外の蛍光斑点が確認されない場合 |
| ・陽性(+): | マイコプラズマと思われる微小な球状、数珠状、フィラメント状粒子 あるいは これらの複合体が核外蛍光斑点として細胞質内および細胞間隙に確認された場合 |
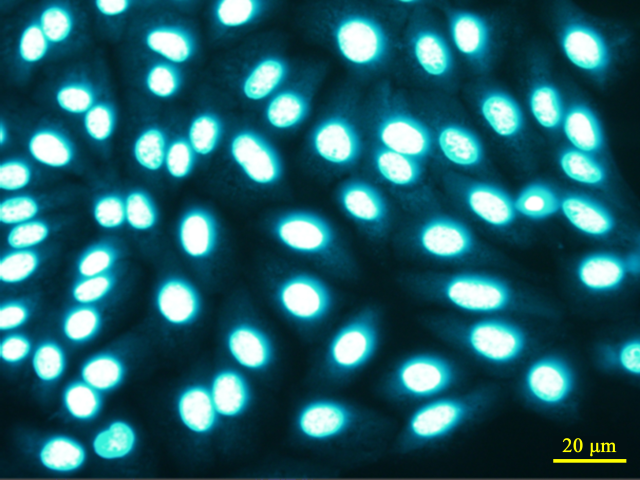 判定(-) |
|
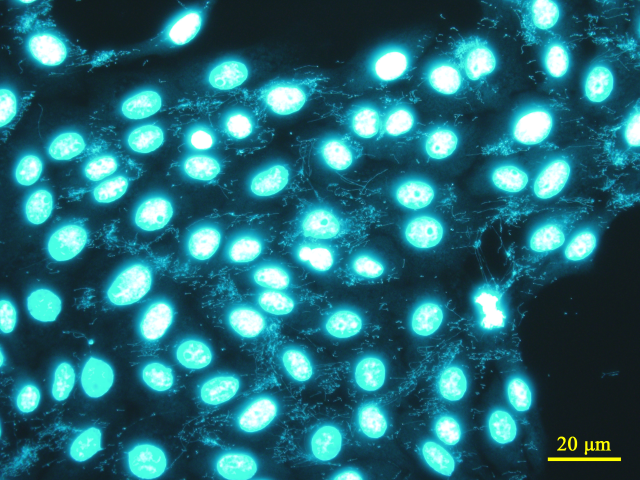 判定(+):フィラメント状 (Mycoplasma fermentans) |
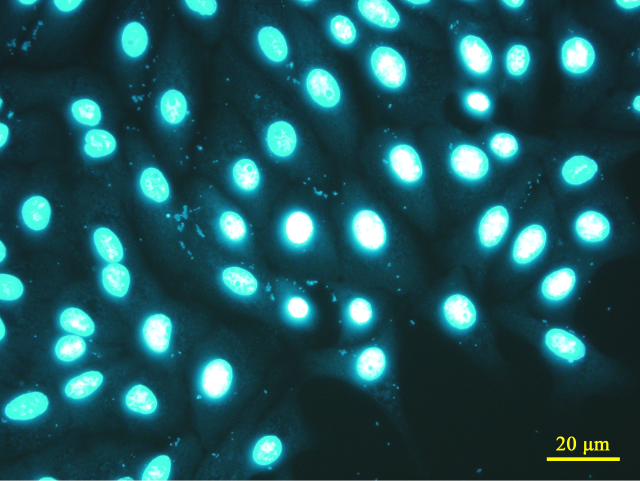 判定(+):球状粒子 (Mycoplasma arginini) |
※ 当室で同定された培養細胞に感染するマイコプラズマの感染画像例 (宿主細胞は全てVero細胞)
・Mycoplasma orale
・Mycoplasma hyorhinis
・Mycoplasma arginini
・Mycoplasma fermentans
・Acholeplasma laidlawii









