レトロウイルスの一種であるHTLV-1(Human T-cell leukemia virus type 1;ヒトT細胞白血病ウイルス1型)は、成人T細胞白血病(adult T-cell leukemia, ATL)の原因ウイルスとして知られています。 HTLV-1のX遺伝子を標的としたprimerを用いて、培養細胞ゲノムにインテグレートされたHTLV-1プロウイルスを PCRによって検出する方法により、細胞材料がHTLV-1に汚染されているかどうかの検査を行っております。
検査対象となる細胞材料は、ヒト血液系由来細胞株およびヒトリンパ球系細胞株です。
1.準備するもの
(1) 検体
| 抽出したゲノムDNA溶液: | 30ng/µl以上 |
| 抽出方法: | およそ6cm dish 1枚分(2×106個程度)の細胞を回収し、PBS(-)で洗浄した細胞ペレットからDNeasy Blood & Tissue Kit ( QIAGEN Cat#69506 ) を用いてゲノムDNAを抽出する。 溶出には抽出キットに添付されているバッファー 200µlを用いる。 |
(2) 機器とPCRチューブ
- 0.2ml PCR tube
- トレー / リテーナー (PCR容器に適合するもの)
- サーマルサイクラー
- アガロースゲル電気泳動装置
- ゲルトレイ、コーム
- トランスイルミネーター
(3) PCRプライマー
- PCRプライマー (参考文献 : S.Kwok et al., Blood, 72(4), 1117-1123, 1988)
- 内部コントロールプライマー
HTLV-1 X forward 5’-CGGATACCCAGTCTACGTGT-3’
HTLV-1 X reverse 5’-GAGCCGATAACGCGTCCATCG-3’
β-globin forward 5’-GGTTGGCCAATCTACTCCCAGG-3’
β-globin reverse 5’-TGGTCTCCTTAAACCTGTCTTG-3’
(4) 試薬
- Ex Taq Hot Start Version ( TaKaRa Cat#RR006A 250unit ) Buffer、dNTP 添付
- 2% アガロースゲル
- サイズマーカー(100bp DNA Ladder)
- 10 x Loading Buffer
- 10 mg/ml EtBr Solution
- DDW
- 陽性対照 : 過去の検査で陽性だったゲノムDNA
- 陰性対照 : 過去の検査で陰性だったゲノムDNA
- 50 x TAE
- 1 x TAE
- 1µg/ml エチジウムブロマイド溶液
| Trizma base | 242g |
| glatinal acetic acid | 57.1ml |
| 0.5m EDTA ( pH 8.0 ) | 100ml |
| Milli-Q水 | 842.9ml |
|
|
|
| / 1L | |
| 50 x TAE | 20ml |
| Milli-Q水 | 980ml |
|
|
|
| / 1L | |
| 10 mg/ml EtBr solution | 10µl |
| 1 x TAE | 100ml |
2.方法
※ ゲノム抽出が済んでいない検体は、予めゲノムの抽出を行う。抽出後の濃度測定で30μg/μl以上であったゲノムDNAはDDWで10倍希釈して用いる。
(1) ゲノムDNA(テンプレートDNA)をミキサーで十分に撹拌する。
(2) PCR mixture を調整し、それぞれの検体をPCRチューブに分注する。
調整する量は検体数+2(ポジティブコントロールx1、ネガティブコントロールx1)分の検体分を用意する。
| PCR misture の組成 | 1検体あたりの液量 |
| テンプレートDNA | 5.0µl |
| PCRプライマー HTLV-I X FW (10pmol/µl) | 0.5µl |
| PCRプライマー HTLV-I X RV (10pmol/µl) | 0.5µl |
| 内部コントロールプライマー β-globin FW (10pmol/ml) | 0.5µl |
| 内部コントロールプライマー β-globin RV (10pmol/ml) | 0.5µl |
| 10 x Ex Taq Buffer | 2.5µl |
| 2.5mM each dNTP mix | 2.0µl |
| DDW | 13.25µl |
| Ex Taq Hot Start Version | 0.25µl |
|
|
|
| 総量 | 25.0µl |
(3) 各検体の入ったPCRチューブをトレー / リテーナーとともにサーマルサイクラーにセットする。
(4) サーマルサイクラーに下記の設定を入力し、反応させる。
Stage 1 : 94℃ 5分 (1サイクル)
Stage 2 : 94℃ 10秒 → 60℃ 1秒 → 72℃ 15秒 (40サイクル)
Stage 3 : 72℃ 5分 (1サイクル)
Stage 4 : 4℃ (保存)
(5) PCR増幅検体 10 µl に 10 x Loading Buffer を1 µl 加える。
(6) 2%アガロースゲルを作製し、電気泳動を行う。
(7) 泳動後のアガロースゲルを1 µg/ml エチジウムブロマイド溶液で染色を行う。
(8) トランスイルミネーターによりDNAのバンドを確認する。
泳動結果例
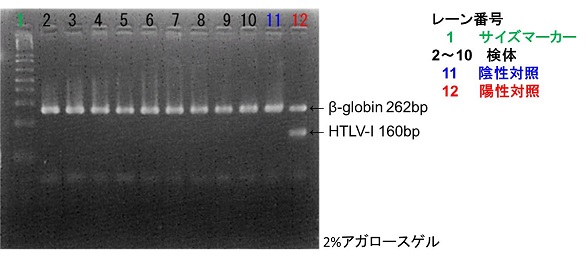
3.判定
陰性対照に160bpのバンドがないこと、陽性対照に160bpのPCR産物のバンドがあることを確認後、検体の判定を行う。(β-globinの262bpのバンドを確認し、PCR阻害がなかったことを確認)
陰性 : バンドがない
陽性 : 160bpのPCR産物のバンドがある





